Clasificación de los aminoácidos de
acuerdo a la naturaleza química de su grupo R:
a) Hidrofóbicos, aromáticos.
b) Hidrofóbicos, alifáticos.
c) Polares, hidrofílicos, con carga.
d) Polares, hidrofílicos, sin carga.
a) Hidrofóbicos, aromáticos.
Existen tres aminoácidos, fenilalanina, tirosina y
triptófano, que presentan cadenas laterales aromáticas. La fenilalanina, junto
con los aminoácidos alifáticos valina, leucina e isoleucina, es uno de los
aminoácidos más hidrófobos. La tirosina y el triptófano también presentan un
carácter ligeramente hidrófobo, aunque atenuado por los grupos polares de sus
cadenas laterales. Además, la tirosina puede ionizarse a pH elevado.
b) Hidrofóbicos, alifáticos.
La valina, la leucina y la isoleucina tienen cadenas
laterales hidrocarbonadas de mayor tamaño. La metionina contiene una cadena
lateral alifática larga que incluye un grupo tioéter (-S-). Las cadenas
laterales alifáticas grandes son hidrofóbicas; es decir, tienden a agruparse
entre ellas en vez de establecer contactos con el agua. La estructura
tridimensional de las proteínas solubles en agua se estabiliza por esta
tendencia los grupos hidrofóbicos a agruparse, lo que se conoce como efecto
hidrofóbico. Los diferentes tamaños y formas de estas cadenas lateral
hidrocarbonadas les permiten empaquetarse para formar estructuras compactas con
pocas cavidades.
c) Polares, hidrofílicos, con carga.
Los aminoácidos con cadenas laterales muy polares que les
convierten en altamente hidrofílicos. La lisina y la arginina tienen cadenas
laterales relativamente largas que acaban en grupos cargados positivamente a pH
neutro. La lisina está rematada por un grupo amino primario y la arginina por
un grupo guanidinio. La histidina contiene un grupo imidazol, un anillo
aromático que también puede estar cargado positivamente.
Con un valor de pK´a cercano a 6, el grupo imidazol puede
estar sin carga o cargado positivamente en las proximidades del pH neutro,
dependiendo del entorno local. Por ello, la histidina se encuentra a menudo en
los centros activos enzimáticos, donde el anillo imidazol puede unir y liberar
protones durente las reacciones que se dan en ellos.
El conjunto de aminoácidos también incluye dos con
cadenas laterales acídicas: el ácido aspártico y el glutámico. Estos
aminoácidos se conocen habitualmente como aspartato y glutamato para resaltar
que sus cadenas laterales a pH fisiológico pierden un protón del ácido y por
ello están cargadas negativamente a pH fisiológico. Sin embargo, en algunas
proteínas estas cadenas laterales aceptan protones, y esta capacidad resulta
normalmente de importancia funcional.
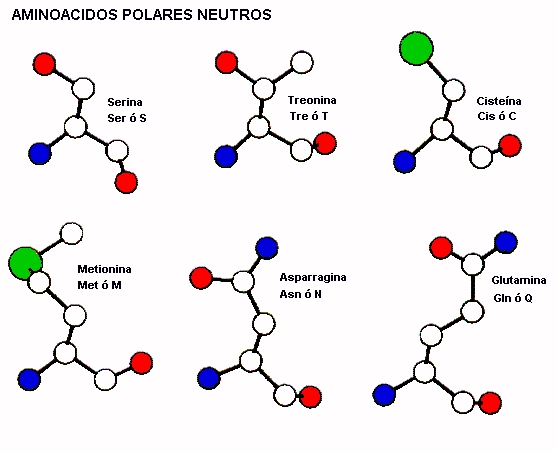
d) Polares, hidrofílicos, sin carga.
Cinco aminoácidos son polares pero sin carga. Dos
aminoácidos, la serina y la treonina contienen grupos hidroxilo alifático
(-OH-). La serina se puede considerar como una versión hidroxilada de la
alanina, mientras que la treonina se asemeja a la valina. Con un grupo hidroxilo
en lugar de uno de los grupos metilo de la valina. Los grupos hidroxilo de la
serina y de la treonina les hacen mucho más hidrofílicos y reactivos que la
alanina y la valina.
No hay comentarios:
Publicar un comentario