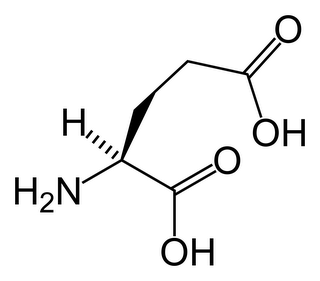
El glutamato
monosódico es la sal sódica del aminoácido
conocido como ácido glutámico (o glutamato) que se encuentra de forma
natural en numerosos alimentos como los tomates, setas, verduras, alimentos
proteicos e incluso la leche materna. No es un aminoácido esencial pero es
la principal fuente de energía del intestino. Su sal purificada, obtenida por fermentación de la caña de azúcar o algunos cereales,
también se utiliza como condimento para potenciar el
sabor de los alimentos y se conoce con el nombre de E621, proteína hidrolizada
o extracto de levadura.
Características
El glutamato monosódico no puede mejorar el
gusto de ingredientes de calidad inferior ni se puede utilizar para conservar o
mejorar el aspecto de los alimentos. La única razón por la que se utiliza este condimento es para potenciar
el sabor y el aroma de la comida y acortar el tiempo de preparación. La cocción
lenta de carnes y verduras así como el uso de ingredientes ricos en glutamato,
tomates, setas, quesos o el jamón curado, consigue el mismo el efecto que el
condimento. Su fórmula es C5H8NO4Na. En su
forma pura, aparece como una sal cristalina de color blanquecino parecida a la
sal o el azúcar; cuando se disuelve en agua, los iones de sodio enseguida se
disocian de los del glutamato. La fórmula química del glutamato que se halla de
forma natural es exactamente igual a la del glutamato refinado. El glutamato es
uno de los aminoácidos más abundantes en
la naturaleza. Una dieta normal ofrece alrededor de 1 g de glutamato en forma
libre, el resto, unos 10 g, se ingiere a través de las proteínas.
Propiedades
Investigaciones recientes muestran que el
glutamato monosódico estimula receptores específicos de la lengua produciendo
un gusto esencial que se conoce con el nombre de umami que significa
gusto sabroso en japonés. Hasta ese momento solo se conocían 4 gustos básicos o
esenciales: dulce, salado, amargo y agrio; con lo que el umami es el quinto
gusto básico. El glutamato fue extraído por primera vez del alga Laminaria japonica mediante un proceso
desarrollado en 1908 por el profesor
de química de la Universidad Imperial de Tokio Kikunae
Ikeda. El estómago también detecta el glutamato. En los últimos años se
ha demostrado que el estómago informa al cerebro de la ingestión de glutamato y
regula la digestión de proteinas. El placer que produce consumir alimentos
sabrosos podría ser una ventaja evolutiva para facilitar la digestión de
proteínas.
Usos
Se utiliza en la cocina como potenciador del sabor de
alimentos. Contiene menos sodio que la sal y en cambio aumenta el sabor de los
alimentos con lo que el glutamato se utiliza para potenciar la palatabilidad de
las comidas bajas en sal. Su uso está muy difundido en la preparación de la
comida asiática como sopas y salsas. También incrementa la apetencia en los
ancianos en los cuales existe una reducción de la sensación del gusto,
particularmente del gusto "umami" o sabroso.
Desde 1968 por una carta al editor del Dr.
Robert Ho Man Kwok en una revista científica en la cual declaraba que algunas
personas después de ingerir comida china sentían dolor de cabeza, ásma,
alergias leves, taquicardia, náuseas, vómitos, opresión en la nuca, en la cara
y en el pecho y en general una sensación de malestar, se desató la polémica del
"Síndrome de restaurante chino". Estos síntomas son
momentáneos y se atribuyó al uso del glutamato monosódico. Sin embargo estos
síntomas no se han podido reproducir de forma experimental. Con lo que los
síntomas descritos por el Dr. Kwok corresponden a una alergia alimentaria. La Federation
of American Societies for Experimental Biology (FASEB), la Organización
Mundial de la Salud y la Comisión Científica de la Unión Europea aprobaron el
uso del glutamato como ingrediente alimentario y lo calificaron apto para el
consumo humano.
Elaboración
El glutamato monosódico se produce a través de la
fermentación, como la salsa de soja o el yogurt, de productos naturales como
las melazas de la caña de azúcar o cereales. Estos se fermentan bajo un
ambiente controlado usando microorganismos (Corynebacterium glutamicum) para pasar luego a ser
filtrados y purificados hasta conseguir el glutamato monosódico refinado. Una
de las companias más conocidas en la elaboración del glutamato monosódico es la
japonesa Ajinomoto.
Efectos
El glutamato monosódico utilizado en pequeñas cantidades
se ha demostrado científicamente, tras treinta años de investigación, que no
presenta ningún riesgo para el consumidor. No puede afectar al cerebro porque
el 95% del glutamato ingerido en la dieta es utilizado por el intestino como
fuente de energía, y además no puede atravesar la barrera
hematoencefálica.
En contra de lo que se cree de forma popular, el glutamato monosódico de la
dieta no tiene ninguna relación con otras enfermedades como la diabetes,
enfermedades del estomago, depresión, etc. Según estudios recientes no se ha
demostrado que el glutamato provoque ningún tipo de efecto nocivos para la
salud. Ni siquiera puede inducir una mayor ingesta de alimentos aunque resalte
el sabor, con lo que no está directamente ligado con la obesidad como popularmente se cree. La
Federation of American Societies for Experimental Biology (FASEB), la
Organización Mundial de la Salud y la Comisión Científica de la Unión Europea
aprobaron el uso del glutamato como ingrediente alimentario y lo calificaron
apto para el consumo humano.
Para discutir más de cerca la controversia científica con
respecto al glutamato, hace poco, un estudio propuso que el consumo masivo
de glutamato monosódico en ratas produce daño en la retina asociándolo con
glaucoma. Del mismo modo, investigaciones realizadas en la Universidad
Complutense de Madrid por Jesús Fernández-Tresguerres, director del
departamento de Fisiología de la Facultad de Medicina, sugieren que la ingesta
de alimentos que contienen enormes cantidades de glutamato monosódico
despierta un hambre ansiosa, hasta el punto de que incrementa la voracidad en
las ratas estudiadas en el 40%. El problema con estos estudios es que usan
cantidades tan exageradas de glutamato que sus resultados tienen poca
aplicación a la hora de valorar los efectos reales del glutamato en su consumo
normal. En el segundo estudio, por ejemplo, se fortificó la dieta de las ratas
con 2.5 o 5 g (10 al 20%) de glutamato -cuando se incrementa tanto un solo
nutriente otros han de disminuir comprometiéndose el equilibrio de la misma-.
Para demostrar lo excesiva que es esta cantidad (del 0.8 al 1.5 % del peso
corporal), 2.5 y 5 g en una rata de 320 g correspondería a una ingesta de 540 g
a 1 kg de glutamato en una persona de 70 kg que en condiciones normales ingiere
como mucho 10 g. En concentraciones normales, un número sustancial de
publicaciones avalan lo seguro que es el consumo del glutamato tal y como lo
encontramos en los alimentos. Únicamente puede tener efectos nocivos cuando se
ingiere solo y en cantidades masivas. El glutamato libre, no asociado a
proteínas, produce un sabor agradable, sabroso, a un 0.5%, la cantidad habitual
en sopas y caldos. Concentraciones de glutamato del 10 al 20% producen un gusto
desagradable si no está ligado a proteínas y causa rechazo.
La explicación que los neurocientíficos quieren dar para
relacionar el consumo de glutamato y obesidad es que este amino ácido actúa
sobre las neuronas de una región cerebral llamada el núcleo arcuato, e impide
el buen funcionamiento de los mecanismos inhibidores del apetito. No hay
evidencias directas que demuestre este mecanismo, y normalmente no hay contacto
directo entre lo que comemos y el cerebro. El intestino es un voraz consumidor
de glutamato para la obtención de energía durante los procesos de digestión y
solo un 5% del glutamato de la dieta pasa a la circulación general cuando lo
ingerimos con la comida.
Hay un testimonio visible en cuanto a la relación entre
el consumo de glutamato y obesidad: los países orientales en los que se consume
más glutamato existe una menor incidencia de obesidad que en los países
occidentales en los que el consumo es mucho menor. Esta observación demuestra
que el culpar al glutamato monosódico por la "epidemia de obesidad"
que se da en los países desarrollados no tiene un fundamento científico serio.
Estudios que sí explicaron el rol particular del glutamato en el apetito son
los que se llevaron acabo en humanos enriqueciendo los alimentos con glutamato
por Bellisle France del Instituto Nacional de la Sanidad e Investigación Médica
en Francia. Esta investigación demostró que es verdad que preferimos los
alimentos que contienen glutamato pero, al contrario de lo que se ha visto en
los modelos experimentales, somos capaces de compensarlo comiendo menos
postres. Al final, el número total de calorías que ingerimos no varía. Con lo
que el glutamato no incrementa ni la voracidad ni el hambre en cantidades
normales. En todo caso, este efecto del glutamato podría ser útil para promover
la selección de alimentos que son nutritivos y tienen poca densidad energética
dejando menos espacio para dulces y pasteles.
No solo es imposible tomar una dieta sin glutamato,
cualquier proteína que ingiramos contiene este amino ácido no esencial, sino
que la falta de glutamato podría vulnerar la integridad del intestino. La
tradición culinaria en la preparación de alimentos va dirigida en realidad a
incrementar la cantidad de glutamato monosódico de los alimentos a través de la
cocción, la fermetación o el proceso de curado y hacerlos así más sabrosos. La
adición de aditivos solo acortan ese proceso de preparación. Productos como la
salsa de tomate, los caldos de pollo, el queso, y el jamón serrano son de por
sí muy ricos en glutamato y se utilizan para incrementar el sabor de las
comidas.
Estas tradiciones culinarias puede que respondan a la
importancia que el glutamato tiene en la salud del estómago e intestino, ya que
nuestro organismo ha desarrollado un mecanismo específico para identificar el
glutamato. Existen receptores en la lengua que se activan con el glutamato dando
el gusto sabroso conocido como umami.
Sin embargo, aunque el organismo puede asimilar el
glutamato procedente de muchas fuentes, el que generalmente se utiliza
artificialmente como potenciador del sabor es el glutamato monosódico (E-621).
Al ser tan abundante en la alimentación habitual diaria actual, puede provocar
un exceso de sodio en el organismo, lo cual genera problemas de hiperactividad
en el sistema nervioso que pueden llegar a provocar una degeneración temprana
del tejido neuronal, propiciando enfermedades nerviosas muy poco frecuentes en
el pasado.